PERÓXIDOS

Los peróxidos consisten en combinaciones binarias del oxígeno junto a ciertos metales. Son derivados de óxidos que contienen la agrupación -O-O-, O22- llamado ión peróxido.
Formulación de los peróxidos
Los peróxidos se formulan utilizando la valencia del oxígeno -1 ya que los dos oxígenos comparten una pareja de electrones por los que en este grupo de elementos no se pueden simplificar las valencias.
La fórmula de los peróxidos es del tipo X2(O2)n (donde X es el elemento metálico, O es oxígeno y n es la valencia del elemento metálico).
Nomenclatura de los peróxidos
Nomenclatura tradicional: la nomenclatura tradicional de los peróxidos se nombra con la palabra peróxido seguida del elemento metálico teniendo en cuenta la valencia del elemento metálico. Los sufijos utilizados siguen el siguiente criterio:
- Una valencia: Peróxido ... ico
- Li+1 + O2-2 » Li2O2: peróxido lítico
- Dos valencias:
- Menor valencia: Peróxido ... oso
- Cu+1 + O2-2 » Cu2O2: peróxido cuproso
- Mayor valencia: Peróxido ... ico
- Cu+2 + O2-2 » Cu2(O2)2 » CuO2: peróxido cúprico
- Menor valencia: Peróxido ... oso
- Tres valencias:
- Menor valencia: Peróxido hipo ... oso
- Ti+2 + O2-2 » Ti2(O2)2 » Ti(O2): peróxido hipotitanioso, dejamos los paréntesis para no confundir con óxido de titanio (IV)
- Valencia intermedia: Peróxido ... oso
- Ti+3 + O2-2 » Ti2(O2)3: peróxido titanioso
- Mayor valencia: Peróxido ... ico
- Ti+4 + O2-2 » Ti2(O2)4 » Ti(O2)2: peróxido titánico
- Menor valencia: Peróxido hipo ... oso
- Cuatro valencias:
- Primera valencia (baja): Peróxido hipo ... oso
- U+3 + O2-2 » U2(O2)3: peróxido hipouranioso
- Segunda valencia: Peróxido ... oso
- U+4 + O2-2 » U2(O2)4 » U(O2)2: peróxido uranioso
- Tercera valencia: Peróxido ... ico
- U+5 + O2-2 » U2(O2)5: peróxido uránico
- Cuarta valencia (alta): Peróxido per ... ico
- U+6 + O2-2 » U2(O2)6 » U(O2)3: peróxido peruránico
- Primera valencia (baja): Peróxido hipo ... oso
Nomenclatura de stock: la nomenclatura de stock se realiza indicando el número de valencia del elemento metálico entre paréntesis y en números romanos, precedido por la expresión "peróxido de" + elemento metálico.
Ejemplo:
Cu2O2: peróxido de cobre (I)
Ti2(O2)3: peróxido de titanio (III)
Ti2(O2)3: peróxido de titanio (III)
En el caso de aquellos elementos metálicos que sólo actúan con una valencia no es necesario indicarla.
Ejemplo:
Li2O2: peróxido de litio en lugar de peróxido de litio (I)
Nomenclatura sistemática: en esta nomenclatura se indica mediante prefijos numéricos seguidos de la expresión óxido + el prefijo correspondiente junto al elemento metálico.
Ejemplos:
Li2O2: peróxido de dilitio
Ti2(O2)3: triperóxido de dititanio
Ti(O2): peróxido de titanio, no se indica el prefijo mono cuando sólo existe un átomo del elemento metálico.
Ti2(O2)3: triperóxido de dititanio
Ti(O2): peróxido de titanio, no se indica el prefijo mono cuando sólo existe un átomo del elemento metálico.
| PERÓXIDOS | ||
| El oxígeno puede actuar con valencia -1 formando los peróxidos, siendo el grupo característico de éstos el O22-. Para nombrarlos se antepone el prefijo per- al nombre del óxido (tradicional). Se pueden hallar duplicando el número de oxígenos del óxido normal. Normalmente no se pueden simplificar, teniéndose que dejar como mínimo un grupo O2 (Siempre par el número de oxígenos). | ||
| FORMULA |
SISTEMÁTICA
|
TRADICIONAL
|
| Li2O2 | dióxido de dilitio | peróxido de litio |
| Na2O2 | dióxido de disodio | peróxido de sodio |
| BaO2 | dióxido de bario | peróxido de bario |
| Cs2O2 | dióxido de dicesio | peróxido de cesio |
| Ag2O2 | dióxido de diplata | peróxido de plata |
| NiO2 | dióxido de níquel | peróxido niqueloso |
| CuO2 | dióxido de cobre | peróxido cúprico |
| Cu2O2 | dióxido de dicobre | peróxido cuproso |
Compuestos binarios, generalmente iónicos, que forma el  con algunos metales, principalmente de los grupos
con algunos metales, principalmente de los grupos  y
y 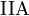 . Se caracterizan por la presencia del
. Se caracterizan por la presencia del 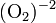 (ión peróxido).
(ión peróxido).
 con algunos metales, principalmente de los grupos
con algunos metales, principalmente de los grupos  y
y 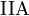 . Se caracterizan por la presencia del
. Se caracterizan por la presencia del 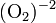 (ión peróxido).
(ión peróxido).
El peróxido solo es estable con la mayor valencia del metal.
Formulación directa[
Tradicional:

Ejemplos:
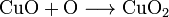 (Peróxido de Cobre)
(Peróxido de Cobre)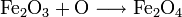 (Peróxido de Hierro)
(Peróxido de Hierro)
No se simplifica ya que se debe mantener la estructura del 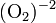 (ión peróxido).
(ión peróxido).
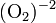 (ión peróxido).
(ión peróxido).Nomenclatura
- Tradicional:
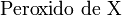
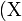 es el elemento en cuestión
es el elemento en cuestión 
Ejemplos:
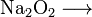 Peróxido de Sodio (Oxilita)
Peróxido de Sodio (Oxilita) Peróxido de Hidrógeno ( en disolución acuosa se conoce como "Agua oxigenada")
Peróxido de Hidrógeno ( en disolución acuosa se conoce como "Agua oxigenada") Peróxido de Bario
Peróxido de Bario
No hay comentarios:
Publicar un comentario